Focus on IP Trend
의약산업은 전반적으로 제품 및 기술의 생명주기(Life cycle)가 길고 법적 규제에 많은 영향을 받는다. 의약산업은 연구개발단계에 투입되는 자원의 규모가 매우 클 뿐만 아니라 기술개발 후 상용화를 위해서도 많은 시간과 R&D 투자를 필요로 한다. 복합적 기술군에 의한 제품화 보다는 소수의 특허군을 통해 한 제품, 한 시장을 독점할 수 있는 특징이 있고, 소수 특허로 제품화가 가능하므로 건당 특허라이선싱 금액이 매우 높다. 이로 인해 의약산업은 특허의 에버그린 전략의 사용빈도가 높다. 지식재산과 의약산업에 대한 이슈로는 제약특허권 존속기간 연장제도, TRIPs협정, 바이오시밀러, 제네릭의약품, 지식재산권 침해, 개발도상국의 의약품 접근성 등에 대한 주제들이 소개되고 있다.
한국 특허청은 2017년 12월, ‘특허권 존속기간 연장등록출원제도 운용에 관한 외국의 법제, 판례 및 문제점에 관한 연구’를 발간하였다. 의약품 등의 발명은 다른 기술 분야와 비교해서 안전성 및 유효성 검증에 장기간이 소요되기 때문에 특허권을 행사할 수 있는 기간이 단축되는 불이익을 보상하기 위해 5년의 범위 내에서 존속기간을 연장시켜주는 ‘존속기간 연장제도’를 두고 있다. 그러나 존속기간 연장의 대상이 되는 특허는 상업적으로 성공한 블록버스터 의약에 대한 것이 대부분이고 국내 제약업계 및 국민보건에 미치는 파장이 커서 존속기간 관련 심판 및 소송 청구가 급증하는 추세이다. 연구 결과, 조사대상 국가들은 의약품 등 발명의 특수성을 고려하여 특허권의 존속기간을 연장해 주지만, 운용 실태는 개별 국가마다 상이한 것으로 나타났다. 이는 존속기간 연장제도가 각국 제약산업 등의 현실 및 경쟁력, 보건의료정책이 반영되는 특수한 제도이기 때문인 것으로 해석된다.
세계무역기구(WTO)는 2017년 1월, 개발도상국의 의약품에 대한 접근을 촉진하기 위한 ‘TRIPS 협정에 대한 개정의정서’의 발효에 따른 TRIPS 협정 개정을 발표하였다. 동 의정서는 의약품 생산기반이 없는 개발도상국 및 최빈국의 의약품 접근을 촉진하기 위하여 2005년 12월 WTO 일반이사회에서 채택된 TRIPS 협정에 대한 개정의정서이다. TRIPS 협정 제31조(f)에 따르면 강제실시권에 기하여 생산된 의약품은 생산국가의 국내 시장에서만 제공이 가능하지만, 동 개정의정서는 해당 조건을 면제하고 WTO 회원국 중 의약품 생산능력이 부족한 개발도상국 및 최빈국은 타국에서 생산되는 제네릭 의약품을 수입할 수 있도록 함으로써 저개발국의 의약품 접근성을 높이고자 한다.
이번 Focus on IP Trend 2월호에서는 의약산업, 의약품접근성, 복제의약품, 바이오시밀러 등에 대하여 알아보고자 “지식재산과 의약산업”을 주제로 선정하였다. 동 주제에 대하여 서로 다른 영역의 활동들이 서로 연관관계를 가지고서 영향을 미치게 되는데, 이에 대한 논의와 해결 방안 모색을 위해 한국지식재산연구원에서 발간된 「Issue & Focus on IP」 가운데 2009년부터 최근까지 국내‧외에서 수집된 기사를 통해 네트워크 분석을 실시하였다. 네트워크 분석 결과 “지식재산과 의약산업”을 중심으로 제네릭의약품, TRIPs, 개발도상국, 의약품접근성, 공중보건, 강제실시 등의 연관 이슈들이 다음과 같은 네트워크 분석 결과로 도출되었다.
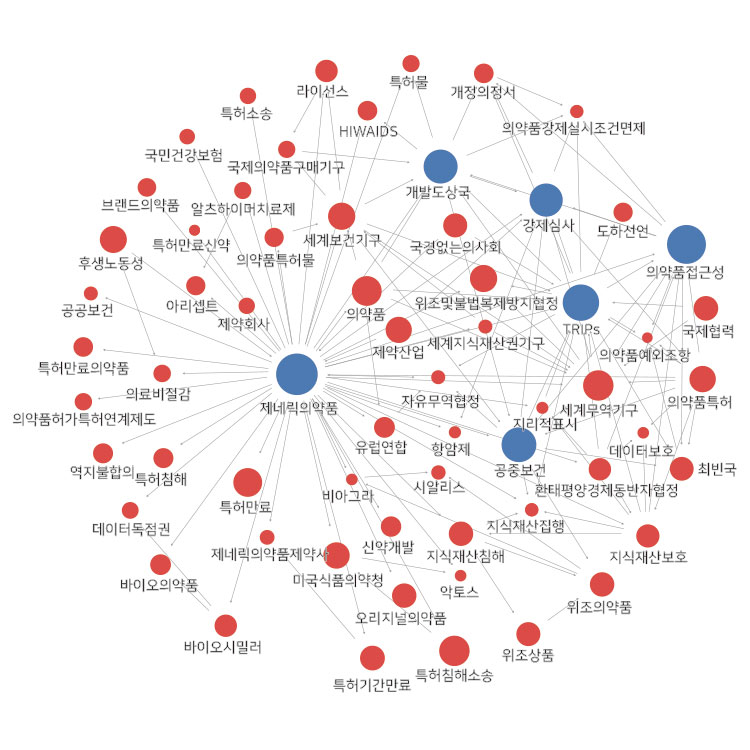
2017년 지식재산과 의약산업 관련 주요 뉴스
특허청(청장 성윤모)은 2017년 12월, ‘특허권 존속기간 연장등록출원제도 운용에 관한 외국의 법제, 판례 및 문제점에 관한 연구’를 발간함. 의약 및 농약(이하 ‘의약품 등’) 특허발명은 약사법 등의 규정에 의한 허가나 등록 없이 그 발명의 실시가 불가능하며, 특히 신물질을 유효성분으로 하는 경우 허가 등을 위한 안전성 및 유효성 검증에 장기간이 소요됨. 이에 의약품 등의 발명이 다른 기술 분야의 발명과 비교 시, 특허권을 행사할 수 있는 기간이 단축되는 특허권자의 불이익을 보상하기 위해 5년의 범위 내에서 존속기간을 연장시켜주는 존속기간 연장제도를 두고 있음
원문 보기세계무역기구(WTO)는 2017년 1월, 개발도상국의 의약품에 대한 접근을 촉진하기 위한 ‘TRIPS 협정에 대한 개정의정서(Protocol Amending the TRIPS Agreement)’의 발효에 따른 TRIPS 협정 개정을 발표함. 동 의정서는 의약품 생산기반이 없는 개발도상국 및 최빈국(least-developed country)의 의약품 접근을 촉진하기 위하여 2005년 12월 WTO 일반이사회(General Council)에서 채택된 TRIPS 협정에 대한 개정의정서임
원문 보기2016년 지식재산과 의약산업 관련 주요 뉴스
2016년 12월 28일, 미국 식품의약국(FDA)은 바이오시밀러 생산자들이 그들이 생산하는 제품이 오리지널 의약품에 얼마나 근접하는지를 입증하는 지침을 발표함. FDA는 2009년 입안된 생물의약품 가격경쟁 및 혁신법(Biologics Price Competition and Innovation Act, BPCIA)을 따르기 위한 노력의 일환으로 바이오시밀러 생산자들이 오리지널 의약품과의 바이오동등성을 입증하는 지침을 마련함
원문 보기2016년 10월 14일, 캐나다 비영리 독립 정책연구기관인 프레이저 연구소(Fraser Institute)는 강력한 특허권 보호는 구명 의약품(Life-Saving Drugs)의 개발과 약가 인하를 촉진한다는 취지의 보고서를 발표함. 처방 의약품 및 의료 기기의 가격은 선진국과 개발도상국 모두에서 오랜 기간 동안 논란이 지속되고 있는 공공 정책상의 문제로, 이 문제의 주요 쟁점 중 하나는 지식재산권을 어느 정도 보호하는 것이 적절한가에 관한 것임
원문 보기2016년 9월 29일, 유럽 지식재산청(EUIPO)은 「제약 산업에서의 지식재산권 침해의 경제적 손실(The Economic Cost of IPR Infringement in the Pharmaceutical Industry)」 보고서를 발표함. 동 보고서는 유럽 지식재산권 침해감시기구(European Observatory on Infringements of Intellectual Property Rights)가 EUIPO와 유럽 특허청(EPO)의 협력을 통해 조사하였으며, 이를 통해 지식재산권 침해에 대한 부정적 영향을 강조하고자 함
원문 보기2016년 3월 29일, 미국 식품의약국(FDA)이 「바이오시밀러 제품 라벨 승인에 관한 업계 지침(Labeling for Biosimilar Products – Guidance for Industry)」초안을 발표함. FDA는 생물의약품 가격경쟁 및 혁신법(Biologics Price Competition and Innovation Act)에 따라 바이오시밀러 의약품 승인 신청과 관련한 절차적·과학적 규약에 대한 일련의 지침을 발간해왔음
원문 보기2015년 지식재산과 의약산업 관련 주요 뉴스
2015년 11월 6일, 세계무역기구(WTO)는 최빈국(LDC) 회원들이 최소 2033년까지 의약품 특허에 대한 접근에 있어 최대한 유연성을 유지할 수 있도록 의약품 관련 예외조항의 적용 연장에 합의함. 이번 결정과 관련하여 동 예외조항에 대해 최빈국들은 지난 2월 WTO에서 개최된 공식회의에서 의약품특허의 보호이행 기한을 연장해줄 것을 제안한 바 있음
원문 보기2015년 11월 5일, 미국 무역대표부(USTR)는 30개의 장(chapter)으로 구성된 환태평양경제동반자협정(TPP)의 협정문을 공개함. USTR은 TPP가 미국의 노동자와 기업이 공정하게 경쟁할 수 있는 장을 마련하여 미국 수출업의 성장과 고소득 일자리 창출에 기여할 것이라고 밝힘
원문 보기2015년 10월 14일, 국경없는 의사회(Médecins Sans Frontières, MSF) 및 국제보건행동(Health Action International)은 유럽연합(EU)의 개발도상국 내 의약품 접근 보호 주력을 촉구하는 「무의미한 태도 : EU의 의약품 접근을 보장하기 위한 책무(Empty gestures: The EU’s commitments to safeguard access to medicines)」보고서를 발표함. 동 보고서는 모든 관련 정책분야에 걸쳐 의약품 정책에 대한 포괄적인 접근을 개발하고 미래의 무역 및 투자협정이 개발도상국의 공중보건을 강화할 수 있도록 하고자 함
원문 보기2015년 3월 15일, 특허청(KIPO)은 의약품 허가특허연계제도 관련 심판사건이 우선심판 대상에 포함되도록 심판사무취급규정을 개정하였다고 밝힘. 의약품 허가특허연계제도는 지난 2007년 한·미 FTA의 체결로 도입되었으며, 2012년 식약청의「제네릭 허가신청사실 통지제도」로 시행됨. KIPO의 심판사무취급규정의 개정은 의약품 허가특허연계제도 실시로 인해 발생할 수 있는 분쟁을 신속히 해결하고 위함임
원문 보기| 일자 | 제목 |
|---|---|
| 2018 01월호 | 지식재산과 통합특허법원 |
| 2017 12월호 | 지식재산과 특허정보 |
| 2017 11월호 | 지식재산과 데이터베이스 |
| 2017 10월호 | 지식재산과 과학기술 |
| 2017 09월호 | 지식재산과 공정거래 |
| 2017 08월호 | 지식재산과 공유 |
| 2017 07월호 | 지식재산 인재양성 |
| 2017 06월호 | 지식재산과 전자상거래 |
| 2017 05월호 | 지식재산과 인공지능(AI) |
| 2017 04월호 | 지식재산과 거버넌스 |
| 2017 03월호 | 지식재산과 국제조약 |
| 2017 02월호 | 지식재산과 빅데이터 |
| 2017 01월호 | 지식재산과 무역 |
| 2016 12월호 | 국가지식재산전략 |
| 2016 11월호 | 제4차 산업혁명과 지식재산 |
| 2016 10월호 | 직무발명 |
| 2016 09월호 | 상표보호 |
| 2016 08월호 | 지식재산 인식제고 |
| 2016 07월호 | 지식재산과 중소기업 |
| 2016 06월호 | 기술이전 |
| 2016 05월호 | 특허심판·소송의 조화와 협력 |
| 2016 04월호 | 지식재산과 연구개발 |
| 2016 03월호 | 지식재산과 조세 |
| 2016 02월호 | 제약산업 |
| 2016 01월호 | 영업비밀보호 |